Validación y mantenimiento de la esterilidad en envases RTU
Garantizar la esterilidad es clave para comprender el diseño de los procesos de esterilización y su impacto. Es importante darse cuenta de que la esterilidad tiene más que ver con las probabilidades que con los valores absolutos. Esto significa que la probabilidad de que un objeto esterilizado contenga organismos supervivientes es muy alta, y cuáles son las consecuencias para el “producto” como resultado de esta garantía, por ejemplo, niveles peligrosos de residuos de esterilizante y/o efectos perjudiciales en los materiales del envase.
Definición de "esterilidad"
La esterilidad se cuantifica en función del nivel de garantía de esterilidad (SAL), que indica que un producto se ha sido esterilizado. Un SAL de 10-6, por ejemplo, es el nivel requerido por la FDA de EE. UU. para dispositivos médicos e inyectables bajo la definición de un enfoque de “sobremanipulación”. Según la USP, la esterilización “excesiva” puede definirse como un método en el que la destrucción de una alta concentración de un microorganismo resistente favorece la destrucción de la carga biológica razonablemente prevista presente en el procesamiento de rutina". Es responsabilidad del fabricante de componentes “estériles” controlar y observar la tendencia de la carga biológica.
El SAL se determina al desafiar el ciclo de esterilización con altos niveles de organismos resistentes y cuantificando el número de unidades formadoras de colonias (UFC) sobrevivientes después de la esterilización. A partir de un proceso no controlado, suele existir una gran variación en la naturaleza y el número de UFC en el producto, tal y como se presentan en el ciclo de esterilización. La variación se determina mediante el control de la preesterilización de los productos para determinar los niveles de carga biológica y la cepa aislada (identificación del organismo) para determinar la resistencia inherente a la modalidad de esterilización. Las superficies casadas, donde dos materiales encajan firmemente entre sí (como el protector de la aguja y el conector de la jeringa), y los lúmenes pequeños (pasajes estrechos como el interior de una aguja de diámetro reducido), representan desafíos significativos para “demostrar” que el esterilizante logrará matar con éxito la carga biológica en estos lugares de difícil acceso.
Las consecuencias de una alta carga biológica
Si los programas de monitorización y tendencias determinan que “el producto” contiene altos niveles de carga biológica, altos niveles de variación en la carga biológica o altos niveles de resistencia, las normativas requieren que los fabricantes aborden los procesos anteriores, por ejemplo, programas de limpieza, frecuencia de limpieza, limpieza microbiológica de los materiales de empaque, procesos de montaje y selección y rotación de agentes antimicrobianos. Si la carga biológica no se controla, puede ser necesario tener que ajustar el ciclo de esterilización para mitigar el riesgo adicional. A medida que es sometida a condiciones de esterilización, la carga biológica inherente se eliminará gradualmente y el número de organismos supervivientes se reducirá y, con suerte, se eliminará. Después de cierto tiempo y bajo las condiciones adecuadas (temperatura, presión, humedad, tiempo y concentración de gas), la probabilidad de supervivencia alcanzará una reducción de10-6 esporas, lo que significa que hay una probabilidad increíblemente baja de que un solo organismo viable sobreviva al ciclo de esterilización.
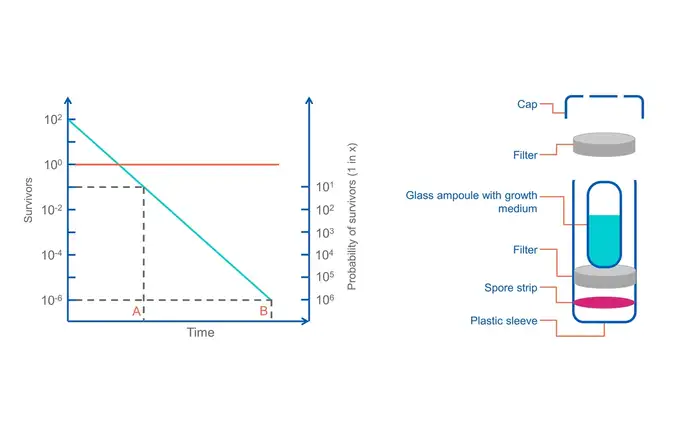
Los dispositivos externos de control de procesos (EPCD) que contienen indicadores biológicos certificados (BI) con >1x10 6 endosporas bacterianas altamente resistentes (verificadas para cada lote mediante pruebas de verificación de población) se colocan en cada palé en cada ciclo. Después del ciclo, los indicadores biológicos se extraen y se transfieren a un medio que promueve el crecimiento. Después de la incubación, si no hay crecimiento, puede estar seguro de que el ciclo de esterilización ha alcanzado el SAL requerido. Esto, junto con la revisión paramétrica del registro de procesamiento del ciclo, nos brinda la garantía de que el ciclo de esterilización fue ejecutado correctamente de acuerdo con los parámetros validados.
Nota: Los indicadores biológicos están disponibles en diferentes concentraciones de SAL, preparados a partir de diferentes organismos, con diferentes resistencias inherentes, para desafiar diferentes modalidades de esterilización (calor, vapor, EtO, haz de electrones, VHP, H2 O2 y gamma).
Un componente estéril mantendrá la esterilidad a lo largo de la cadena de valor mediante el uso de procesos validados y envases primarios y secundarios debidamente diseñados.
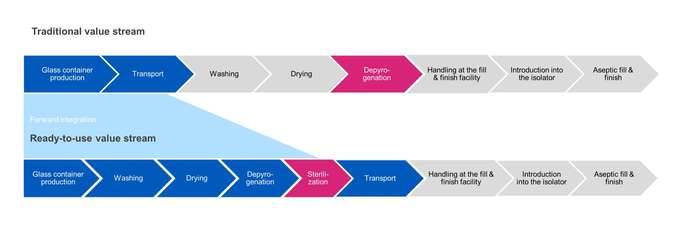
En el llenado a granel tradicional, la esterilización del envase se lleva a cabo en el paso de despirogenación. Los productos se lavan, se secan y se pasan a través de un túnel de calor para ser despirogenizados a temperaturas elevadas (280-350 °C) para garantizar su esterilidad antes de ser transferidos directamente a la operación de llenado.
Por el contrario, la esterilización del recipiente RTU se lleva a cabo después del envasado final y antes del transporte a las instalaciones de llenado y acabado aséptico. En los siguientes pasos del proceso, se retira el envasado exterior y el envasado interior sellado se transfiere asépticamente a la operación de llenado. Existen retos a la hora de garantizar que la esterilidad se mantenga entre el punto de salida de la cámara de esterilización y el punto de entrada a un aislador aséptico.
En pocas palabras, la esterilidad está relacionada con las probabilidades, donde el riesgo de que sobrevivan organismos en un objeto debe minimizarse mediante procesos validados y soluciones de envasado calificadas. Para el embalaje RTU, la esterilidad debe garantizarse desde el punto de esterilización hasta que llega al aislador aséptico.
En las próximas semanas profundizaremos en cómo evitar la contaminación y garantizar la esterilidad de principio a fin para el envasado primario RTU.
Envasado primario RTU (listo para usar) de SCHOTT Pharma
SCHOTT iQ® es una plataforma integral para estandarizar los componentes de envase listos para su uso (RTU) y mejorar la calidad de los contenedores RTU. Con SCHOTT iQ®, el desarrollo y suministro de fármacos inyectables de alta calidad se vuelve eficiente y mejora significativamente la seguridad de los pacientes.
Las variantes disponibles en la plataforma SCHOTT iQ® son adaptiQ®, syriQ® y cartriQ®, todas ellas embaladas en bandejas estandarizadas.

Dr. Robert Lindner
Product Manager Bulk & Sterile Solutions