
Asuntos regulatorios farmacéuticos — Servicios de apoyo regulatorio Apoyo regulatorio completa para la integración del contenido de envases farmacéuticos primarios en los registros de medicamentos y dispositivos médicos
CONTÁCTENOSFacilitar una integración perfecta en el registro de productos farmacéuticos
Los servicios de asuntos regulatorios farmacéuticos ayudan a los propietarios de productos farmacéuticos o dispositivos médicos a poner a disposición información sobre los sistemas de contención para su registro. SCHOTT Pharma garantiza la disponibilidad normativa global de sus soluciones de contención de conformidad con las normas y estándares internacionales en evolución, así como con las leyes y directrices específicas de cada país. Diferentes países siguen diferentes procesos de registro de producto farmacéuticos:
-
En los países en los que se siguen los enfoques del archivo maestro de medicamentos (DMF) o el registro nacional de productos, SCHOTT Pharma registra el envase farmacéutico por separado del medicamento o dispositivo médico.
-
En muchas otras regiones, como la UE, Sudamérica y Australia, el propietario del producto farmacológico o dispositivo médico debe presentar la documentación de envasado farmacéutico como parte del expediente de aplicación.

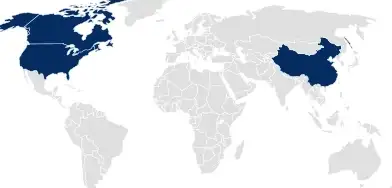
Archivo maestro de medicamentos (DMF)
Para EE. UU., Canadá y China, SCHOTT Pharma archiva DMF (dossier de registro de un medicamento), que abarcan toda la documentación relacionada con el sistema de envasado y sirven como referencia para la aplicación de productos farmacéuticos o dispositivos médicos.
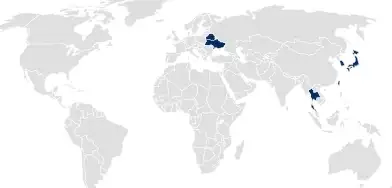
Registro nacional de productos
Para los países que siguen a los registros nacionales de productos farmacéuticos, SCHOTT Pharma registra el sistema de almacenamiento. Se puede hacer referencia a este registro en aplicaciones de productos farmacéuticos o dispositivos médicos para cubrir todos los aspectos de los sistemas de almacenamiento.
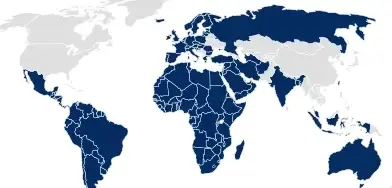
Expedientes de envasado
Para los países en los que la información de envase debe ser enviada como parte de la aplicación del medicamento (por ejemplo, la UE, Australia), SCHOTT Pharma ofrece un dossier de envases farmacéuticos personalizado en formato eCTD para una fácil integración.
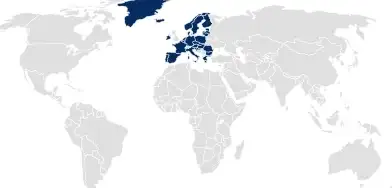
Expedientes de regulación de productos sanitarios (MDR)
Para los registros de dispositivos médicos en la UE, SCHOTT Pharma facilita la cobertura de la documentación relacionada con el envase, al personalizar los paquetes de expedientes para que coincidan con el nivel de detalle requerido para los MDR.
Conocimiento experto y alcance global
Para ayudar a que su producto forme parte del registro de productos farmacéutocos en sus países de destino, SCHOTT Pharma cuenta con un equipo de expertos y una red global para permitir la disponibilidad normativa de nuestras soluciones de contención en todo el mundo y ofrecer apoyo farmacéutico para abordar fácilmente los asuntos farmacéuticos. Para simplificar la integración del contenido de la solución de contención, nos regimos por tres principios clave:
- Hablamos el idioma de la industria farmacéutica.
- Trabajamos con expedientes de la industria farmacéutica en formatos estándar, como eCTD.
- Supervisamos constantemente la evolución de las normativas para el envasado farmacéutico.









