
肖特医药法规服务 全面帮助将初级 药用 包装内容整合到药物和医疗器械注册中
联系我们支持无缝集成到制药注册中
监管服务助力药品及医疗器械所有者高效获取容器系统信息,为注册工作提供核心支持。肖特制药确保旗下容器解决方案的全球合规性,不仅严格遵循持续演进的国际标准,更精准契合各国本土法律与准则。针对不同国家的注册流程差异,我们提供适配性服务:
- 在采用药品主文件(DMF)或国家产品注册模式的国家,肖特制药将负责药品包装的独立注册,与药品或医疗器械注册相互分离;
- 而在欧盟、南美、澳大利亚等地区,药品包装文件需由药品或医疗器械所有者纳入申请档案一并提交,我们将提供完备资料支持这一流程。

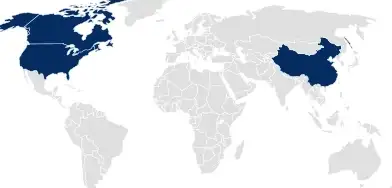
药品主文件(DMF)
肖特医药包装为美国、加拿大和中国提交 DMF,其中涵盖了所有与容器系统相关的文档,并在药品或医疗器械注册中被引用。
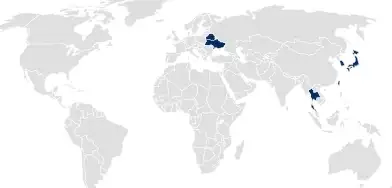
国家产品注册
对于采取国家产品注册的国家,肖特医药包装为其注册包装系统。在药品或医疗器械申请中可以引用这一注册,以涵盖容器系统的所有方面。
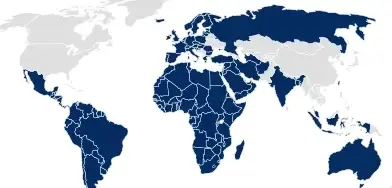
包装档案
在有些国家,包装信息必须作为药物申请的一部分提交(例如欧盟、澳大利亚),肖特医药包装为这些国家提供 eCTD 格式的定制档案,确保轻松整合所有信息。
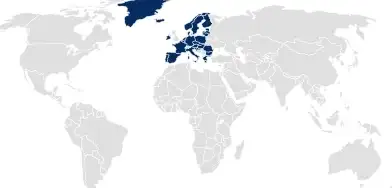
医疗器械法规 (MDR) 档案
对于欧盟医疗器械注册,肖特医药通过定制档案包,以匹配 MDR 所需的详细程度,支持轻松囊括与容器相关的文件。
肖特医药专业知识和全球影响力
为助力您的产品顺利进入目标市场,肖特制药凭借专业团队与全球网络,为容器解决方案提供覆盖全球的合规监管支持。为简化容器解决方案与注册流程的整合,我们遵循三大核心原则:
- 采用制药行业通用术语
- 以 eCTD 等行业标准格式编制档案
- 持续追踪药品包装法规动态,实时响应合规要求变化。









