
Regulatorische Dienstleistungen Umfassende Unterstützung bei der Integration von Inhalten zu den verwendeten pharmazeutischen Primärpackmitteln in die Dokumentation von Medikamenten- und Medizinproduktzulassungen
KONTAKTIEREN SIE UNSUnterstützung einer nahtlosen Integration in Pharmazulassungen
Unsere regulatorischen Dienstleistungen unterstützen die Hersteller von Medikamenten oder Medizinprodukten in der Vorbereitung der Zulassung, indem sie die Informationen über das Primärpackmittelsystem verfügbar machen. SCHOTT Pharma stellt die weltweite regulatorische Verfügbarkeit seiner Primärpackmittelsysteme in Übereinstimmung mit den sich ändernden internationalen Normen und Standards sowie länderspezifischen Gesetzen und Vorgaben sicher. In unterschiedlichen Ländern gelten unterschiedliche Zulassungsverfahren:
-
In Ländern, die DMF- (Drug Master File) oder nationale Produkzulassungsansätze verfolgen, meldet SCHOTT Pharma pharmazeutische Verpackungen unabhängig vom Medikament beziehungsweise Medizinprodukt an.
-
In vielen anderen Regionen, wie der EU, Südamerika und Australien, muss die Dokumentation zum Primärpackmittelsystem vom Inverkehrbringer des Medikaments oder Medizinprodukts als Teil des Beantragungsdossiers eingereicht werden.

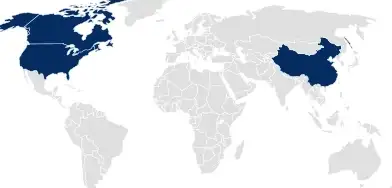
Drug Master Files (DMF)
In den USA, Kanada und China reicht SCHOTT Pharma ein DMF ein, das die gesamte Dokumentation zum Aufbewahrungssystem umfasst und als Referenz für Medikamenten- oder Medizinprodukt-Anträge dient.
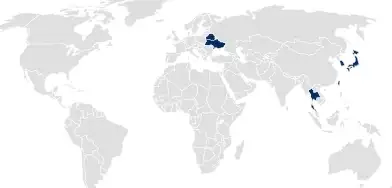
Nationale Produktzulassung
Für Länder, die nationale Produktzulassungen verlangen, übernimmt SCHOTT Pharma die Zulassung des Primärpackmittelsystems. Auf diese Zulassung kann in den Zulassungsanträgen für Medikamente oder Medizinprodukte verwiesen werden, um alle Aspekte des Primärpackmittelsystems abzudecken.
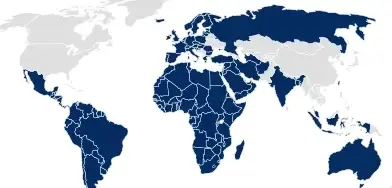
Pharmazeutische Packaging Dossiers
Für Länder, in denen das Primärpackmittelsystem als integraler Teil der Arzneimittelzulassung vorgelegt werden muss (z. B. EU, Australien), bietet SCHOTT Pharma artikelspezifische Dossiers an. Diese werden bereits im von den meisten Behörden zur Einreichung geforderten eCTD-Format erstellt und lassen sich somit leicht in das Gesamtdossier der Zulassungseinreichung integrieren.
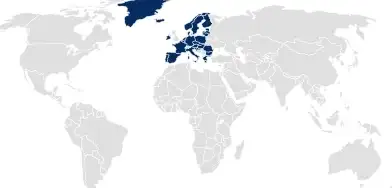
Dossier zur Zulassung von Medizinprodukten (MDR)
Für die Zulassung von Medizinprodukten in der EU unterstützt SCHOTT Pharma durch die Erstellung von artikelspezifischen Dossierpaketen, die auf den für Medizinproduktzulassungen nach MDR erforderlichen Detaillierungsgrad zugeschnitten sind.
Expertenwissen und globale Reichweite
Um Ihre Produkte in Ihren Zielländern verfügbar zu machen, verfügt SCHOTT Pharma über ein Expertenteam und ein globales Netzwerk, das für die regulatorische Verfügbarkeit unserer Primärpackmittel auf der ganzen Welt sorgt. Zur Vereinfachung der Integration von Inhalten zu Primärpackmittel-systemen verfolgen wir drei Hauptprinzipien:
- Wir sprechen die Sprache der Pharma-Branche.
- Wir arbeiten mit Pharmaindustrie-Dossiers in Standardformaten wie eCTD.
- Wir beobachten kontinuierlich die sich ändernden Vorschriften für pharmazeutische Verpackungen.









