Validierung und Aufrechterhaltung der Sterilität in RTU-Packaging
Die Gewährleistung der Sterilität ist der Schlüssel zum Verständnis des Designs von Sterilisationsprozessen und ihrer Auswirkungen. Es ist wichtig zu wissen, dass es bei der Sterilität um Wahrscheinlichkeiten und nicht um absolute Werte geht. Das heißt, wie groß ist die Wahrscheinlichkeit, dass sich auf einem sterilisierten Gegenstand überlebende Organismen befinden, und welche Folgen hat diese Garantie für das „Produkt“, z. B. gefährliche Mengen an Sterilisationsmittelrückständen und/oder schädliche Auswirkungen auf die Verpackungsmaterialien.
Die Definition von Sterilität
Die Sterilität wird anhand des Sterility Assurance Level (SAL) quantifiziert, der angibt, dass ein Produkt steril gemacht wurde. Ein SAL von 10-6 ist zum Beispiel der Wert, den die amerikanische FDA für Medizinprodukte und Injektionen fordert, die unter die Definition eines „Overkill“-Ansatzes fallen. Laut USP kann die „Overkill“-Sterilisation als eine Methode definiert werden, bei der die Zerstörung einer hohen Konzentration eines resistenten Mikroorganismus der Zerstörung einer zu erwartenden Keimbelastung bei der Routineverarbeitung entspricht.“ Es obliegt dem Hersteller von „sterilen“ Komponenten, die Keimbelastung zu überwachen und zu beobachten.
Der SAL wird bestimmt, indem der Sterilisationszyklus mit einer hohen Anzahl resistenter Organismen durchgeführt und die Anzahl der überlebenden koloniebildenden Einheiten (KBE) nach der Sterilisation bestimmt wird. Bei einem unkontrollierten Prozess gibt es typischerweise eine große Variation in der Art und Anzahl der KBEs auf dem Produkt, das in den Sterilisationszyklus gelangt. Die Variation wird durch die Überwachung des Produkts/der Produkte vor der Sterilisation auf den Grad der Keimbelastung und die Speziation der Isolate (Organismus-ID) bestimmt, um die inhärente Resistenz gegen die Sterilisationsmethode zu ermitteln. Sich berührende Oberflächen, bei denen zwei Materialien eng aneinander liegen (wie z. B. der Nadelschutz und der Spritzenansatz), und kleine Lumen (schmale Durchgänge, wie z. B. die Innenseite einer kleinen Nadel) stellen eine große Herausforderung dar, wenn es darum geht, den Nachweis zu erbringen, dass das Sterilisationsmittel an diesen schwer zugänglichen Stellen erfolgreich biologische Verunreinigungen abtötet.
Die Folgen einer hohen Keimbelastung
Wenn Überwachungs- und Trendprogramme feststellen, dass „das Produkt“ ein hohes Maß an Keimbelastung, ein hohes Maß an Schwankungen der Keimbelastung oder ein hohes Maß an Resistenz aufweist, verlangen die Vorschriften von den Herstellern, dass sie sich mit den vorgelagerten Prozessen befassen, z. B. mit Reinigungsprogrammen, der Reinigungshäufigkeit, der mikrobiologischen Sauberkeit der Verpackungsmaterialien und den Montageprozessen sowie mit der Auswahl und dem Wechsel von antimikrobiellen Mitteln. Wenn die Keimbelastung nicht unter Kontrolle ist, muss der Sterilisationszyklus möglicherweise angepasst werden, um das zusätzliche Risiko zu minimieren. Die inhärente Keimbelastung wird unter Sterilisationsbedingungen allmählich abgetötet und die Anzahl der überlebenden Organismen reduziert und hoffentlich eliminiert. Nach einer gewissen Zeit und unter den richtigen Bedingungen (Temperatur, Druck, Feuchtigkeit, Zeit und Gaskonzentration) erreicht die Wahrscheinlichkeit des Überlebens 10-6 , was bedeutet, dass die Wahrscheinlichkeit, dass ein einziger lebensfähiger Organismus den Sterilisationszyklus überlebt, unglaublich gering ist.

Externe Prozessprüfmittel (EPCDs) mit zertifizierten biologischen Indikatoren (BI), die >1x106 hochresistente bakterielle Endosporen enthalten (für jede Charge durch Populationsverifizierungstests geprüft), werden in jedem Zyklus auf jeder Palette platziert. Nach dem Zyklus werden die biologischen Indikatoren entfernt und in ein wachstumsförderndes Medium transferiert. Ist nach der Inkubation kein Wachstum vorhanden, können Sie sicher sein, dass der Sterilisationszyklus den erforderlichen SAL erreicht hat. Zusammen mit der parametrischen Überprüfung des Zyklusverarbeitungsprotokolls gibt uns dies die Gewissheit, dass der Sterilisationszyklus gemäß den validierten Parametern erfolgreich durchgeführt wurde.
Hinweis: Biologische Indikatoren sind in verschiedenen SAL-Konzentrationen erhältlich, die aus verschiedenen Organismen mit unterschiedlicher inhärenter Resistenz hergestellt werden, um verschiedene Sterilisationsmodalitäten (Wärme, Dampf, EtO, E-Beam, VHP, H2O2und Gamma) zu testen.
Eine sterile Komponente erhält die Sterilität entlang der Wertschöpfungskette durch den Einsatz validierter Prozesse und entsprechend konzipierter Primär- und Sekundärverpackungen aufrecht.
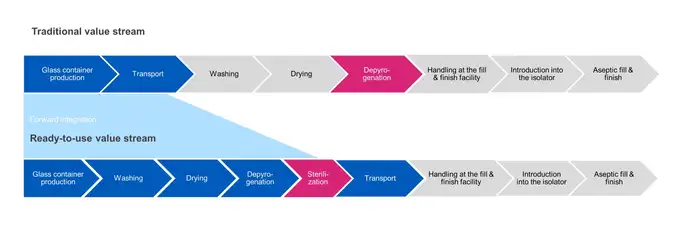
Bei der traditionellen Bulkabfüllung erfolgt die Sterilisation des Behälters während der Depyrogenisierung. Die Produkte werden gewaschen, getrocknet und dann durch einen Hitzetunnel geführt, um sie bei hohen Temperaturen (280-350 °C) zu depyrogenisieren, um sicherzustellen, dass sie steril sind, bevor sie direkt zum Abfüllvorgang weitergeleitet werden.
Im Gegensatz dazu erfolgt die Sterilisation von RTU-Behältern nach der finalen Verpackung und vor dem Transport zur aseptischen Abfüllanlage. In den anschließenden Prozessschritten wird die Außenverpackung entfernt und die versiegelte Innenverpackung aseptisch in den Abfüllvorgang transferiert. Die Aufrechterhaltung der Sterilität zwischen dem Austritt aus der Sterilisationskammer und dem Eintritt in einen aseptischen Isolator stellt eine Herausforderung dar.
Kurz gesagt, bei der Sterilität geht es um die Wahrscheinlichkeit, dass Organismen auf einem Objekt überleben, die durch validierte Prozesse und qualifizierte Verpackungslösungen minimiert werden muss. Bei RTU-Verpackungen muss die Sterilität vom Zeitpunkt der Sterilisation bis zum Erreichen des aseptischen Isolators gewährleistet sein.
In den kommenden Wochen werden wir näher darauf eingehen, wie Sie bei RTU-Primärverpackungen eine Kontamination verhindern und die Sterilität durchgängig sicherstellen können.
RTU-Primärverpackungen von SCHOTT Pharma
SCHOTT iQ® ist eine ganzheitliche Plattform zur Standardisierung von Ready-to-Use (RTU) Verpackungskomponenten und zur Verbesserung der Qualität von RTU-Containern. SCHOTT iQ® ermöglicht die effiziente Entwicklung und Verabreichung von hochwertigen injizierbaren Medikamenten, bei gleichzeitiger Verbesserung der Patientensicherheit.
Verfügbare Varianten innerhalb der SCHOTT iQ® Plattform sind adaptiQ®, syriQ® und cartriQ®, die alle in standardisierten Tubs verpackt sind.

Dr. Robert Lindner
Product Manager Bulk & Sterile Solutions
Themen
Melden Sie sich für die neuesten Nachrichten an
Bleiben Sie mit Informationen über SCHOTT Pharma Produkte und Services auf dem Laufenden und melden Sie sich für unseren Newsletter an.