Vorbereitung der Zulassungsanträge zur Arzneimitteleinreichung
KONTAKTIEREN SIE UNSBewältigung von Komplexität bei der Vorbereitung der Arzneimitteleinreichung
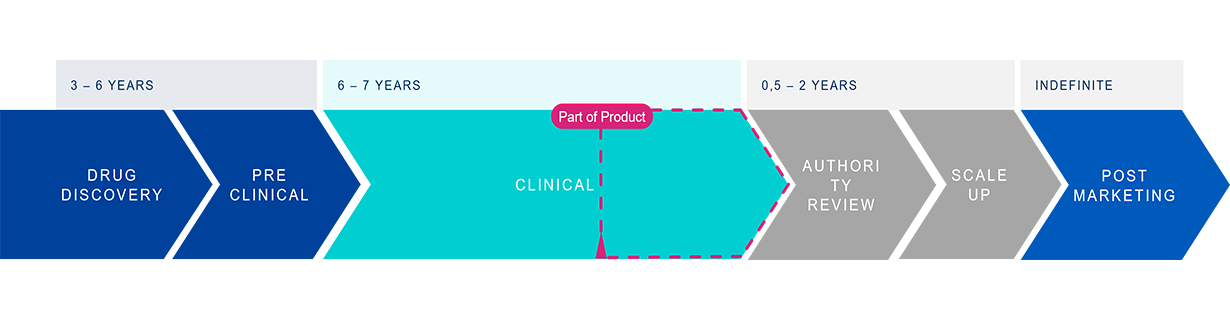
Die Vorbereitung auf die behördliche Zulassung neuer Arzneimittel erfordert gründliche verpackungsbezogene Tests, um die Sicherheit und Wirksamkeit des Medikaments zu gewährleisten. Diese Tests umfassen ein breites Spektrum an Bewertungen, einschließlich der Materialcharakterisierung, der Wechselwirkung zwischen Medikament und Behälter, der Integrität des Behälterverschlusses und der funktionalen Leistung. Solche umfassenden Tests sind nicht nur für die Einhaltung strenger gesetzlicher Vorschriften, sondern auch für die Gewährleistung der Patientensicherheit unerlässlich.
Optimierung der Prüfverfahren für die Einhaltung von Vorschriften und die beschleunigte Einreichung
Pharmazeutische Unternehmen stehen bei der Einreichung von Arzneimitteln oft vor der Herausforderung, ein Gleichgewicht zwischen internen Teams und externen Labors für ihre Testanforderungen zu finden. Interne Teams sind zwar stark in die Entwicklung involviert, verfügen aber möglicherweise nicht über das nötige Fachwissen für einige spezifische Testverfahren. Auf der anderen Seite bieten externe Labors zwar Fachwissen für Testmethoden, stellen aber oft Herausforderungen bei der Koordination und Ergebnisintegration dar, was zu einem fragmentierten Prozess mit uneinheitlichen Ergebnissen führt.
Die Bewältigung interner Ressourcenknappheit und die Verwaltung externer Lieferanten wird zu einem Risiko für eine schnelle Markteinführung. Angesichts der Komplexität und des hohen Einsatzes in der Vorbereitungsphase für die Einreichung von Anträgen tragen die Pharmaunternehmen eine große Verantwortung, indem sie sicherstellen, dass ein Höchstmaß an Patientensicherheit unter engsten Zeitvorgaben erreicht wird.
Vier Tests zur Vorbereitung Ihres Zulassungsantrags
Die Prüfung der Materialverträglichkeit ist von grundlegender Bedeutung, um sicherzustellen, dass die Materialkandidaten für die Verwendung der Medikamentenaufbewahrung geeignet sind. Die Prüfung der Materialverträglichkeit dient der:
- Einhaltung rechtlicher Anforderungen – Gewährleistung der Einhaltung globaler Standards für die Verwendung von Materialien in pharmazeutischen Verpackungen.
- Übereinstimmung mit der vorgesehenen Spezifikation – Bestätigung von Parametern wie chemische Zusammensetzung und Schichtdicke (z.B. Silikon oder andere Beschichtungen).
Dazu gehört eine strenge Bewertung der Materialeigenschaften der Primärverpackungskomponenten aus Glas, Polymer oder Elastomer. Zu den Prüfungsverfahren gehören:
- Konformitätsprüfung – standardisierte Tests zur Sicherstellung der Materialkonformität mit den in den Pharmakopöen definierten Anforderungen.
- Komponentencharakterisierung – Tests umfassen die Messung der Schichtdicke oder die Bewertung der gesamten oder leicht entfernbaren Silikonmenge.
- Partikelanalyse – charakterisiert die Reinheit von Materialien und deckt potenzielle Verunreinigungsquellen aus der Produktion auf.
Wechselwirkung von Medikamenten mit der Aufbewahrungslösung stellt ein kritisches Risiko für die Wirksamkeit des Medikaments dar. Eine ordnungsgemäße Bewertung prüft die Kompatibilität der Arzneimittelformel mit den Kontaktmaterialien des Systems. Die Prüfung der Wechselwirkung von Behältern und Arzneimitteln dient der:
- Sicherstellung der Wirksamkeit des Arzneimittels – Überprüfung, ob das Behältnis die therapeutische Wirkung des Arzneimittels nicht verändert.
- Gewährleistung einer sicheren Lagerung – Bestätigung der Abwesenheit von kritischen toxischen Nebenprodukten, die durch die Wechselwirkung zwischen Medikament und Behälter während der Lagerung entstehen.
Die Prüfung der Wechselwirkung zwischen Medikament und Behältnis beinhaltet eine detaillierte Analyse der Wechselwirkung zwischen Medikament und Behältnis, um mögliche chemische und physikalische Veränderungen während der Lagerzeit vorherzusagen. Zu den Prüfungsmethoden gehören:
- Delaminationsstudien – beurteilen das Risiko einer Materialabbaus und dessen Auswirkungen auf das Arzneimittel.
- Partikelanalyse – zählt und charakterisiert Partikel, die durch die Wechselwirkung zwischen Arzneimittel und Behälter entstehen.
- Extractables Studien – bewertet potenzielle Chemikalien, die aus dem Behälter auslaufen könnten.
- Leachable Studien – untersucht die Auswirkungen von auslaugbaren Stoffen auf die Arzneimittelstabilität und die Patientensicherheit.
- Analyse elementarer Verunreinigungen – stellt sicher, dass keine schädlichen Elemente in der Verpackung vorhanden sind.
Die Unversehrtheit von Behälterverschlüssen ist entscheidend für die Gewährleistung der Sterilität und Qualität eines pharmazeutischen Produkts während seiner gesamten Lebensdauer. Eine ordnungsgemäße Prüfung ermöglicht die Bewertung der Verpackung eines Arzneimittels im Hinblick auf das Risiko von Produktaustritt. CCIT dient zur:
- Gewährleistung der Wirksamkeit und Sicherheit von Arzneimitteln – es wird das Systemdesign zur Unterstützung der Sterilität und Stabilität eines pharmazeutischen Produkts überprüft.
- Nachweis der Einhaltung gesetzlicher Vorschriften – Übereinstimmung mit globalen Standards, einschließlich FDA- und EMA-Richtlinien.
- Bestätigt dse Designs – es beweist die Wirksamkeit gegen Kontamination und Integritätsverletzungen.
CCIT stellt sicher, dass Behälter wie Fläschchen und Spritzen undurchlässig für Verunreinigungen sind, was ein wesentlicher Aspekt der Patientensicherheit und der Wirksamkeit von Arzneimitteln ist. CCIT beinhaltet folgende Tests:
- Farbstoffpenetrationstest – identifiziert mikroskopische Lecks in Behälterverschlüssen, um die Integrität der Versiegelung zu überprüfen.
- Headspace-Analyse – bewertet die Veränderung der Gaszusammensetzung in versiegelten Behältern im Laufe der Zeit, um die Fähigkeit von Gas zu bestimmen, in das Behälterverschlusssystem einzudringen.
Funktionsprüfungen validieren den Entwurf eines Produkts, um die anwendungsspezifischen Benutzeranforderungen und gesetzlichen Normen zu erfüllen. Die Funktionsprüfung dient der:
- Sicherstellung der Leistung – sie validiert die Betriebszuverlässigkeit und Wirksamkeit des Behälters.
- Gewährleistung der Konformität des Systems – sie erfüllt die strengen Branchen- und Sicherheitsvorschriften.
Mit dieser Gruppe von Tests wird die zuverlässige Funktionalität des Systems unter den spezifischen Bedingungen des vorgesehenen Einsatzes und während der gesamten Produktlebensdauer überprüft. Dies ist insbesondere bei Kombinationsprodukten wie Arzneimitteln in vorgefüllten Spritzen oder Injektionsgeräten relevant. Typische Testverfahren charakterisieren das System für:
- Losbrech- und Gleitkraft – beurteilt die Leichtigkeit der Dosierung.
- Abgabe- und Restvolumen – für eine genaue Dosierung und minimale Verschwendung.
- Flüssigkeitsaustritt – gewährleistet die Unversehrtheit des Behälters unter einer Vielzahl von Bedingungen.
- Wiederverschließbarkeit des Septums – validiert die Fähigkeit des Verschlusses, sich nach der Perforation wieder versiegeln zu lassen.
- Bruchfestigkeit von Flansch und Luer-Konus – prüft die mechanische Festigkeit gegen Bruch.
Das PartnerLab von SCHOTT Pharma: Pharmazeutische Prüfungen zur behördlichen Einreichung
Es ist wichtig, die Bedeutung und Komplexität des Zulassungsprozesses in der Pharmaindustrie zu verstehen. Unser hochmodernes, FDA-registriertes Labor ist mit erfahrenen Fachleuten besetzt und vereinfacht und rationalisiert diesen Prozess. Mit PartnerLab bieten wir eine umfassende Palette von Prüfdienstleistungen an, die darauf ausgerichtet sind, die vielfältigen und strengen Anforderungen an Arzneimittelverpackungen und Interaktionstests zu erfüllen.Über die Tests hinaus arbeiten wir mit Ihnen zusammen, um die Sicherheit und den Erfolg Ihres Produkts zu gewährleisten. Indem Sie uns die komplexen Aufgaben der Prüfung und Einhaltung von Vorschriften anvertrauen, können Sie sich auf Ihre Kernkompetenzen konzentrieren und darauf vertrauen, dass Ihre Leistungstests fachmännisch durchgeführt werden. PartnerLab optimiert Ihren Prüfungsprozess, beschleunigt Ihren Zulassungsantrag und erhöht die Sicherheit und Qualität Ihrer Produkte.